欧洲如何提高医药研究透明度
○作者 尚塔尔·布莱特 ○译者 杨旭东
青年参考
(
2014年02月12日
35
版)
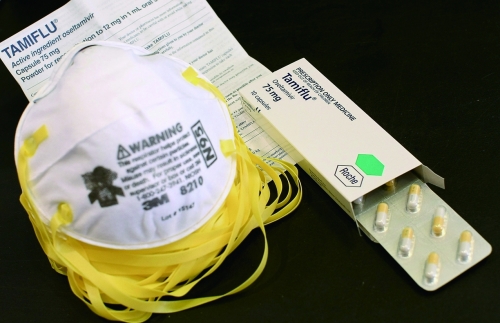
2009年4月,仅400多万人口的新西兰为应对新流感疫情的暴发,储备了约140万剂抗流感药物达菲。□图片来源 CFP
制药公司经常在新药的试制和销售过程中都“发挥影响力”。
近年来,许多国家的医疗费用持续增长,为了解那些昂贵新药的药效,医药监管部门、医生和病人对于医学科研结果报告的依赖性越来越大。那么,如果科研结果不属实怎么办?
不良数据被调整和优化
前几年,因为可能爆发流感疫情,各国政府大张旗鼓地购置、存储由跨国制药公司罗氏(Roche)生产的抗病毒药物达菲。各国花费了数十亿美元购买数量庞大的药物,但罗氏一直不愿公开有关该药物的具体科研数据,以至于连医生都不知道这种预防针剂是否真能抑制流感疫情。
在业界,这种将“不满意”的科研结果掩藏起来的做法,被称为“发表偏倚”——只公布有利的数据。倘若医学研究受到人为操纵,那么新发明的药物可能不仅毫无药效,甚至带来风险。
医药科研人员能通过变更极限值的方法来降低指标,或者使用模棱两可的统计方式,突出正面效果而淡化副作用。如果一项研究得出了令人不满意的结果,就会被锁进抽屉里封存,因为无人愿意看到它。
“不良结果令医生充满恐惧,他们不愿将其公布于众。”瑞士外科医生简-弗朗索斯·科塔特透露,教授们会掩盖那些不符合要求的结果,并对其进行调整和优化。
市场上流传着“潜规则”
“企业对公布畅销产品的负面科研结果更不感兴趣。”瑞士医科院总秘书赫尔曼·阿姆斯塔德说,“医学专业杂志则只愿发表那些正面的研究结果。”
世界范围内,每年约进行70000个医学科研项目,但只有少数能得出新见解,更多的是带有广告性质的炒作,肿瘤学家瑞图·奥博利斯特说。他是瑞士药物批准和监督机构Swissmedic的理事会成员。
奥博利斯特透露,不被公布的医疗科研数据占了一小半,这导致结果不详,而且令医生在选择药物时面临困难。而许多科研结果之所以不被公布,是因为不符合制药业的要求。
为改变现状,瑞士一项于年初生效的新法规定,所有在瑞士进行的科研实验必须登记注册,同时为了保证质量和透明度,所有参与人员除行规外,还要遵守附加的道德规范准则及公正交易条例。
“市场上流传着不成文的规定——企业应该只做那些不怕被媒体报道的事。”瑞士临床实验机构(SCTO)负责人安妮特·马格宁指出,不正当行为不仅在道义上受谴责,还会带来经济损失,同时影响企业声誉。
瑞士制药业每年创造的价值占国民生产总值的6%。过去几年里,该行业一直反对公开科研结果,他们按照行业联盟自己制定的行为准则办事。
近一段时间,很多企业开始改变做事风格,加强透明度,比如罗氏刚刚公布了所有医药科研的总结报告。第三方科研人员可以通过卫生机构或者直接从罗氏查找这些报告。不仅如此,从2014年年初开始,罗氏还向第三方科研人员敞开了患者层面的原始资料。
针对达菲的药效,一个独立科研小组对数据进行了检验。根据罗氏的说法,这种药的“效果和安全性”得到了证实。
2013年,罗氏总裁丹尼尔·奥黛说过这样的话:“我们理解和支持社会上对我们行业科研结果透明度的要求,这关乎病人的利益,对医药事业也有好处。”同时,罗氏认为评估和批准药物的权利必须保留在卫生机构手中。
一些药物生产商强调,完全公开数据也存在缺点。比如在保护病人数据和知识产权上,如果数据全部公开,就会产生漏洞。瑞士制药业研究机构联盟Interpharma的托马斯·库埃尼说,他认为行业内部制定的规则已经够用。
对此,科塔特可不表赞同。“制药业自认为有良好的规范,但官方机构依然提出了信息公开的问题,要求更加透明,这就说明制药业做得还是不够。这让人联想起前不久治理银行业时的情景。”
美国的公开度和透明度最高
过去几年,瑞士企业在道德规范上的表现遭到了强烈批评,不仅金融行业的人为操纵、贪污和保密行为被曝光,制药业也名誉受损。
跨国公司经不起名誉受损带来损失,所以这些公司会尽量遵守市场行为准则和各种法规。但是首先他们要为前些年的行为负责,在那些不良新闻爆料中,各大制药公司都有份。
罗氏因达菲、诺华(Norvatis)公司因降压药代文(Diovan)引起了公众的注意,因为他们没有或者未能及时公布有关这两种药物的不利数据。奥博利斯特希望通过公众对透明度的要求改变现状。
“如今,制药业的‘出名度’已经与银行业不相上下,”他说,“想恢复名誉,重新获得信任,需要很长时间。”
在科研的公开度和透明度上,美国做得最好,欧洲被甩在了后面。美国从1997年就开始实行医药科研登记制度,制药公司必须把与利益有所冲突的数据公布于众。2000年,美国政府决定开放带有医药科研数据的网站。2013年9月开始,美国制药公司必须向医生公开所有科研数据,自此,制药公司已向卫生部门公开了价值20亿美元的数据。
现在,瑞士也开始尝试登记制度,而欧盟计划从明年开始引进该制度。到2015年,欧盟必须在医药科研开始之前就进行登记,并在科研结束一年之内公布总结报告。
批评家认为,欧盟现有的和计划中的相关法律并不与时俱进,或者涉及面不够。一些组织警告,无法证明效果的“昂贵的假冒创新”科研会令患者对医生失去信任。
“药物生产商坚称把患者放在首位,但经济效益也不能忽略,”德国No free lunch组织的大卫·克伦培勒说,“为了在2017年将价值17亿美元的药物打入市场,制药业、医生、政治家和媒体已经形成系统,为了改善各自形象,故意隐瞒不符合要求的数据。”
时间将证明,新法规是否能达到应有的效果。
□瑞士资讯网
发表偏倚
达菲被各国卫生机构大批量存储,以备流感爆发时救急。而罗氏常年不愿公开有关这种药物的科研数据报告,理由是“门外汉进行的鉴定不靠谱”。
独立科研鉴定机构Cochrane指出了罗氏隐藏60%数据资料的事实。2009年,这家机构得到了全部相关数据,但依然能找到发表偏倚(只公布有利数据)的痕迹。
2013年,Cochrane终于能就所有与达菲有关的科研数据进行鉴定,但数据被罗氏修改过,理由是“要维护患者隐私和保障经济利益”。
今天,罗氏对透明度的要求表示支持,因此第三方科研人员如果要求查看医药科研结果,可以从罗氏得到1998年以前的数据。一个独立专家小组对所有数据进行了分析,专门解答有关达菲的问题。
日本卫生部今年年初将另一家知名制药公司诺华告上了法庭,罪名是误导性广告。卫生部称,诺华在日本大学所做的科研实验的部分数据被人为改动,目的在于夸大降压药代文的药效。
爱可泰隆制药公司在2011年初宣布,因安全问题停止生产安眠药物阿莫伦特。美国《福布斯》杂志去年12月的报道指出,该公司曾多年向其他制药公司封锁有关这一安眠药的信息。
近年来,许多国家的医疗费用持续增长,为了解那些昂贵新药的药效,医药监管部门、医生和病人对于医学科研结果报告的依赖性越来越大。那么,如果科研结果不属实怎么办?
不良数据被调整和优化
前几年,因为可能爆发流感疫情,各国政府大张旗鼓地购置、存储由跨国制药公司罗氏(Roche)生产的抗病毒药物达菲。各国花费了数十亿美元购买数量庞大的药物,但罗氏一直不愿公开有关该药物的具体科研数据,以至于连医生都不知道这种预防针剂是否真能抑制流感疫情。
在业界,这种将“不满意”的科研结果掩藏起来的做法,被称为“发表偏倚”——只公布有利的数据。倘若医学研究受到人为操纵,那么新发明的药物可能不仅毫无药效,甚至带来风险。
医药科研人员能通过变更极限值的方法来降低指标,或者使用模棱两可的统计方式,突出正面效果而淡化副作用。如果一项研究得出了令人不满意的结果,就会被锁进抽屉里封存,因为无人愿意看到它。
“不良结果令医生充满恐惧,他们不愿将其公布于众。”瑞士外科医生简-弗朗索斯·科塔特透露,教授们会掩盖那些不符合要求的结果,并对其进行调整和优化。
市场上流传着“潜规则”
“企业对公布畅销产品的负面科研结果更不感兴趣。”瑞士医科院总秘书赫尔曼·阿姆斯塔德说,“医学专业杂志则只愿发表那些正面的研究结果。”
世界范围内,每年约进行70000个医学科研项目,但只有少数能得出新见解,更多的是带有广告性质的炒作,肿瘤学家瑞图·奥博利斯特说。他是瑞士药物批准和监督机构Swissmedic的理事会成员。
奥博利斯特透露,不被公布的医疗科研数据占了一小半,这导致结果不详,而且令医生在选择药物时面临困难。而许多科研结果之所以不被公布,是因为不符合制药业的要求。
为改变现状,瑞士一项于年初生效的新法规定,所有在瑞士进行的科研实验必须登记注册,同时为了保证质量和透明度,所有参与人员除行规外,还要遵守附加的道德规范准则及公正交易条例。
“市场上流传着不成文的规定——企业应该只做那些不怕被媒体报道的事。”瑞士临床实验机构(SCTO)负责人安妮特·马格宁指出,不正当行为不仅在道义上受谴责,还会带来经济损失,同时影响企业声誉。
瑞士制药业每年创造的价值占国民生产总值的6%。过去几年里,该行业一直反对公开科研结果,他们按照行业联盟自己制定的行为准则办事。
近一段时间,很多企业开始改变做事风格,加强透明度,比如罗氏刚刚公布了所有医药科研的总结报告。第三方科研人员可以通过卫生机构或者直接从罗氏查找这些报告。不仅如此,从2014年年初开始,罗氏还向第三方科研人员敞开了患者层面的原始资料。
针对达菲的药效,一个独立科研小组对数据进行了检验。根据罗氏的说法,这种药的“效果和安全性”得到了证实。
2013年,罗氏总裁丹尼尔·奥黛说过这样的话:“我们理解和支持社会上对我们行业科研结果透明度的要求,这关乎病人的利益,对医药事业也有好处。”同时,罗氏认为评估和批准药物的权利必须保留在卫生机构手中。
一些药物生产商强调,完全公开数据也存在缺点。比如在保护病人数据和知识产权上,如果数据全部公开,就会产生漏洞。瑞士制药业研究机构联盟Interpharma的托马斯·库埃尼说,他认为行业内部制定的规则已经够用。
对此,科塔特可不表赞同。“制药业自认为有良好的规范,但官方机构依然提出了信息公开的问题,要求更加透明,这就说明制药业做得还是不够。这让人联想起前不久治理银行业时的情景。”
美国的公开度和透明度最高
过去几年,瑞士企业在道德规范上的表现遭到了强烈批评,不仅金融行业的人为操纵、贪污和保密行为被曝光,制药业也名誉受损。
跨国公司经不起名誉受损带来损失,所以这些公司会尽量遵守市场行为准则和各种法规。但是首先他们要为前些年的行为负责,在那些不良新闻爆料中,各大制药公司都有份。
罗氏因达菲、诺华(Norvatis)公司因降压药代文(Diovan)引起了公众的注意,因为他们没有或者未能及时公布有关这两种药物的不利数据。奥博利斯特希望通过公众对透明度的要求改变现状。
“如今,制药业的‘出名度’已经与银行业不相上下,”他说,“想恢复名誉,重新获得信任,需要很长时间。”
在科研的公开度和透明度上,美国做得最好,欧洲被甩在了后面。美国从1997年就开始实行医药科研登记制度,制药公司必须把与利益有所冲突的数据公布于众。2000年,美国政府决定开放带有医药科研数据的网站。2013年9月开始,美国制药公司必须向医生公开所有科研数据,自此,制药公司已向卫生部门公开了价值20亿美元的数据。
现在,瑞士也开始尝试登记制度,而欧盟计划从明年开始引进该制度。到2015年,欧盟必须在医药科研开始之前就进行登记,并在科研结束一年之内公布总结报告。
批评家认为,欧盟现有的和计划中的相关法律并不与时俱进,或者涉及面不够。一些组织警告,无法证明效果的“昂贵的假冒创新”科研会令患者对医生失去信任。
“药物生产商坚称把患者放在首位,但经济效益也不能忽略,”德国No free lunch组织的大卫·克伦培勒说,“为了在2017年将价值17亿美元的药物打入市场,制药业、医生、政治家和媒体已经形成系统,为了改善各自形象,故意隐瞒不符合要求的数据。”
时间将证明,新法规是否能达到应有的效果。
□瑞士资讯网
发表偏倚
达菲被各国卫生机构大批量存储,以备流感爆发时救急。而罗氏常年不愿公开有关这种药物的科研数据报告,理由是“门外汉进行的鉴定不靠谱”。
独立科研鉴定机构Cochrane指出了罗氏隐藏60%数据资料的事实。2009年,这家机构得到了全部相关数据,但依然能找到发表偏倚(只公布有利数据)的痕迹。
2013年,Cochrane终于能就所有与达菲有关的科研数据进行鉴定,但数据被罗氏修改过,理由是“要维护患者隐私和保障经济利益”。
今天,罗氏对透明度的要求表示支持,因此第三方科研人员如果要求查看医药科研结果,可以从罗氏得到1998年以前的数据。一个独立专家小组对所有数据进行了分析,专门解答有关达菲的问题。
日本卫生部今年年初将另一家知名制药公司诺华告上了法庭,罪名是误导性广告。卫生部称,诺华在日本大学所做的科研实验的部分数据被人为改动,目的在于夸大降压药代文的药效。
爱可泰隆制药公司在2011年初宣布,因安全问题停止生产安眠药物阿莫伦特。美国《福布斯》杂志去年12月的报道指出,该公司曾多年向其他制药公司封锁有关这一安眠药的信息。

 上一版
上一版








 缩小
缩小 全文复制
全文复制




